ボトックスビスタは日本で唯一の厚生労働省が認可。
ボトックスビスタ®は、ボツリヌス菌が産生したA型ボツリヌス毒素を製剤化したタンパク質医薬品です。A型ボツリヌス毒素は末梢の神経筋接合部に作用し、運動神経終末からのアセチルコリン放出を阻害します。これにより、神経筋伝達が遮断され筋弛緩作用を生じ、筋肉の過度の緊張による眉間の表情皺を改善します。
ボツリヌス菌Clostridium botulinum により産生されるA型ボツリヌス毒素を有効成分とする。末梢の神経筋接合部における神経筋伝達を阻害することにより、筋弛緩作用を示し、「65歳未満の成人における眉間又は目尻の表情皺」を改善します。
ボトックスビスタ®は25年以上の歴史あり!
ボトックスは、1970年代からアメリカで開発され、製剤として20年以上臨床で安全に使用されてきた歴史があります。現在世界80カ国以上で20以上の適応症の承認を受けています。
| 年 | 概要 |
| 1970s〜1980s | 臨床開発のスタート |
| 1989 | アメリカで斜視及び眼瞼痙攣(がんけんけいれん)の適応症の承認 |
| 1996 | 日本で眼瞼痙攣(がんけんけいれん)の適応症の承認 |
| 2000 | 片側顔面痙攣(かたがわがんめんけいれん)の適応症の承認 |
| 2001 | 痙性斜頸(けいせいしゃけい)の適応症の承認 |
| 2002 | アメリカで眉間の表情しわの適応症の承認 |
| 2009 | 日本国内初!眉間の表情しわの適応症の承認 2歳以上の小児脳性麻痺による下肢痙縮(かしけいしゅく)に伴う尖足の適応の承認 |
| 2013 | アメリカで目尻の表情しわの適応症の承認 |
| 2016 | 日本国内初!目尻の表情しわの適応症の承認 |
※その他適応症の一部
上肢痙縮、下肢痙縮、斜視、重度の原発性腋窩多汗症、慢性偏頭痛における頭痛の予防、過活動膀胱炎、振戦、手掌の多汗症など
ボトックスビスタの特徴
- 局所的な神経筋伝達阻害作用により筋肉を弛緩させるため、筋肉の過度の緊張による眉間又は目尻の表情皺(じわ)の治療に有効です。
- 一般に投与後2~3日で効果が期待できます。
- ボトックス治療は対症療法であり、神経筋伝達阻害作用は時間経過とともに効果が弱まり、通常、効果は3~4ヵ月ほど持続します。
厚生労働省が承認しているボトックスビスタを使用するメリットは?
日本で唯一の厚生労働省に認可されている「ボトックスビスタ®注用50単位」には、以下のような安全性や品質管理上のメリットがあります。
- ボトックスビスタ®が原因の副作用などの被害は、医薬品副作用被害救済制度という公的な制度による救済給付の対象となることがあります。注1)
- ボトックスビスタ®は、厳正な医薬品管理の下、無菌状態で製造・保管・輸送しています。
- ボトックスビスタ® を用いるボトックス治療は、アラガン・ジャパン株式会社(ボトックスビスタ® のメーカー)による公式の講習セミナーを受け、十分な知識・経験のある限定された医師のみが施術することができます。
ボトックス治療を受ける前に必ず確認してください!
 眉間&目尻の表情じわのボトックス治療と表記できるのは「ボトックスビスタ」を用いた治療のみ
眉間&目尻の表情じわのボトックス治療と表記できるのは「ボトックスビスタ」を用いた治療のみ
ボトックスビスタ®以外のA型ボツリヌス毒素製剤を使ったボツリヌス治療は、「ボトックス治療」とは呼ぶことができません。
なぜならボトックスとは、アメリカ法人のアラガンインコーポレーテッド(米国アラガン社:日本法人はアラガン・ジャパン株式会社という)が有する登録商標 (「BOTOX®」、「BOTOX VISTA®」)を取得しているからです。
そのため、眉間&目尻の表情じわの治療を受ける際には、クリニックで使われている薬剤が「ボトックスビスタ®」であることをWEBサイトの閲覧やお電話でご確認ください。
世界で認められているボトックス®
ボトックスビスタ®は世界94カ国で認可されていて、20以上の適応症を有しています。
眉間又は目尻の表情皺 → 世界80ヵ国*以上で承認(2015年6月)
○その他適応症
眼瞼痙攣、片側顔面痙攣痙性斜頸、上肢痙縮、下肢痙縮、2歳以上の小児脳性麻痺患者における下肢痙縮に伴う尖足、斜視、重度の原発性腋窩多汗症、慢性偏頭痛における頭痛の予防、過活動膀胱炎、振戦、手掌の多汗症。
引用:ボトックスビスタ®注用50単位添付文書
アメリカではボトックス治療が非手術的美容治療でNO.1の人気治療!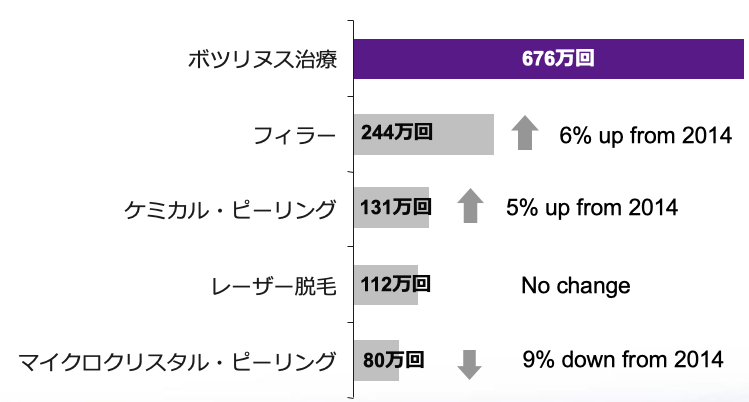
引用:American Society of Plastic surgeons 2015 Plastic Surgery Statistic Report Data



